topics
創薬困難とされてきた標的に対する革新的な医薬品の創出に挑む
ファイメクスは、タンパク質分解を作用機序とした新規医薬品の研究開発を進める創薬ベンチャー企業です。独自性の高い自社の創薬プラットフォームにて、これまでの医薬品開発では創薬が困難とされてきたタンパク質を標的とする事を目指しています。創業者の冨成CEOと蒲CSOの同技術に対する熱意と使命感が高く、同技術に興味を持つ従業員が集まってきています。京都iCAPは、ファイメクスの活動支援を続けると共に、同社が開発する革新的な新薬が医療や患者に貢献する事を望んでいます。
京都大学イノベーションキャピタル株式会社 投資担当者より

ファイメクス株式会社は、創薬の新規モダリティである標的タンパク質分解誘導剤を用いて、これまでundruggable(創薬困難)とされてきた標的に対する革新的な医薬品の創出を目指すバイオベンチャーだ。武田薬品工業株式会社(以下、タケダ)の研究者らが、同社のベンチャー設立支援制度を活用して2018年1月に設立した。起業の経緯や確立した標的タンパク質分解誘導剤プラットフォームの独自性などについて、共同創業者で代表取締役CEOの冨成祐介氏と取締役CSOの蒲香苗氏に聞いた。(聞き手:増田克善 2023年5月取材)
新たな創薬技術の価値を信じて起業
自身のキャリアと起業した経緯をお聞かせください。
冨成 東京大学大学院薬学研究科の天然物合成化学教室を経て、2006年にタケダに入社しました。がん研究部門で抗がん剤の研究開発、その後炎症に関わる研究グループで免疫疾患の創薬に従事してきました。そうした中で2014年頃から、長期的な視点でインパクトのある研究アイディアを検証するため、有志によるワーキンググループ「F-iMec(Future immunology-Unit Medicinal Chemistry)」で活動していました。
そのWGでは、当初私は、既存の創薬技術では創薬が困難とされている、いわゆる“Undruggable Targets”をどうやって薬にするかというテーマを研究していました。その研究でがん免疫に使えそうなIRAK-Mという創薬標的に着目しましたが、IRAK-Mはシュードキナーゼと呼ばれるタンパク質に属しており、取得したバインダーでは機能を阻害するのは困難であることがわかり、早期に中止しました。一方、標的タンパク質分解誘導剤の技術が注目を集め始めていたことから、次に取り組むテーマとして考えていましたが、すでに取得済みのIRAK-Mのバインダーと組み合わせれば薬にできるのではないかと考え、初期検討を経てプロジェクトとして提案しました。
一度は、最優先課題として評価されたものの、その矢先に研究開発体制が変わり、がん免疫を含むがん領域の研究開発は米国ボストンに集約されることになりました。当時、湘南研究所は主に中枢疾患にフォーカスすることになり、メディシナルケミストは、会社に残って中枢疾患の仕事をするか、他の製薬企業に転職するか、あるいはタケダが提供するベンチャー設立制度を利用し、起業して研究開発を続けるか岐路に立たされたわけです。共同操業する仲間も見つかったので、タケダのアントレプレナーシップベンチャープログラムというベンチャー設立支援制度を使用して起業する道を選びました。

蒲 父が生物学者だったこともあり、特に生命現象や病気の成り立ちに興味を持ち生物学を専攻しました。大阪大学大学院薬学研究科を卒業して2009年にタケダに入社し、がんの薬を創りたいという一心で生物学研究に従事してきました。
私もWGにBiologist(生物学者)として参画していましたが、冨成の話にもあったように研究部門の大きな組織改革があり、当時の方針では、湘南研究所ではがん領域の創薬研究ができないことに・・・。独り身であればボストンに行っていたと思いますが、家族やキャリアを考えると踏み切れませんでした。一方、他の製薬企業に転職しても組織変革や方針変更によって同じようなことが待ち受ける可能性は高いという危惧もありました。自分たちが戦略を立て、追求したい研究で果実を得ることが可能な選択肢をタケダから与えられたからには、それを生かさなければ後悔するという気持ちが大きく共同創業者の道を選択しました。
起業に際して苦労したことは何でしたか。
冨成 ベンチャー設立支援制度によってタケダの出資を受けるにあたり、タケダ以外からの出資を獲得することも重視されました。たくさんのベンチャーキャピタルを回りましたが、当時はまだ私たちの技術に対して懐疑的に見られることも多く、なかなか出資に応じてもらえるところがなく、結果的にバイオ研究用試薬や研究用機器の事業会社であるコスモ・バイオ株式会社のみでした。しかも、その交渉も期限ギリギリの段階で、わずか3日で投資を決定していただけたことで起業することができました。創業メンバーは蒲のほかに2名がWGメンバーから参画しスタートしましたが、海外では競合がどんどん立ち上がるフェーズだったため、研究を続けなければならない一方で資金調達の仕事も継続しなければならず大変でした。
2018年末の学会発表を機に京都大学大学院医学研究科の先生から接触があり、先生が研究している化合物と私たちの技術を掛け合わせれば画期的な新薬の創出が可能なのではという議論になり、がんにかかわる新薬の共同研究がまとまりました。その頃に京都iCAPとの話も始めており、投資いただくことができました。私たちが開発するタンパク質分解誘導剤が、治療手段がない患者さんへの新たな治療手段となる可能性を評価され、京都iCAPをはじめ東大IPC(東京大学協創プラットフォーム開発株式会社)、ANRIによるファンドから資金調達することができました。

独自の創薬プラットフォーム技術を確立
研究開発の内容や技術の強みについて、ご紹介ください。
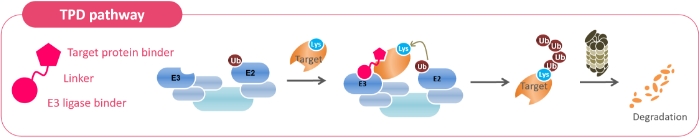
冨成 私たちが目指しているのは、新しい創薬アプローチである標的タンパク質分解誘導剤(TPD:Targeted Protein Degradation)という技術によって、これまで創薬困難とされてきた標的に対する革新的な医薬品を創出することです。分解したい異常なタンパク質(標的)に対して、分解するための目印を付けるE3リガーゼというタンパク質がタンパク質-タンパク質間相互作用 (PPI: Protein-Protein Interaction)によって結合するとユビキチンが標的に移って、ユビキチンを目印にプロテアソームという酵素が標的のタンパク質を分解するというメカニズムが生体内で起こっています。これを化合物で実現しようというアプローチです。ただし、E3のリガーゼが変われば分解されるタンパク質も変わる、あるいは相互作用の仕方によっても分解対象が変わることが明らかになっています。タンパク質-タンパク質間相互作用は標的タンパク質及びE3リガーゼの相性が大きく影響するからです。対象となるタンパク質を分解するためにはE3リガーゼ、化合物の結合部位、タンパク質-タンパク質間相互作用の強さなどからなる無数の組み合わせの中から最適な組み合わせを探し出す必要があります。私たちの中では、最適と思われる組み合わせを計算化学によりデザインするのは現段階では無理だろうというと結論になり、それならばすべてを作ってしまおうという発想で構築したのが独自の創薬プラットフォームです。
冨成 独自技術である標的タンパク質分解誘導剤探索プラットフォーム「RaPPIDS(Rapid Protein Proteolysis Inducer Discovery System)」は、分子骨格の異なる多様な化合物を効率よく作り出す多様性指向型合成(DOS: Diversity-Oriented Synthesis)をベースとしており、創薬標的への活性を示す化合物(リード化合物)の創出と得られたリード化合物の最適化の2段階で構成されます。大きな特徴は化合物を自動合成することが可能で、効率よく最適な医薬品化合物を短期間で創出できることであり、差別化できる強みでもあります。
創業時から本格的に開発を続け、現在では自動合成を活用して1週間で1000個以上の標的タンパク質分解誘導剤を合成できる段階まできました。これによって、標的タンパク質分解誘導剤としての利用実績があるE3リガーゼの報告は10前後しかない一方で、当社では600を超える全E3リガーゼを対象に探索することが可能となっています。Phenotypic-firstのアプローチであることから、化合物がどのE3リガーゼを使用しているかの特定は後回しになるものの、分解活性が認められれば、リード化合物であったり、創薬の標的として相応しいものか見極めるためのツール化合物だったりに利用できます。そのため通常の手法と比べて、低コストかつ早期にGo/No Goの判断が可能となる点が特徴です。一方、分解に寄与しているE3リガーゼが何かの特定を進めつつ、化合物の最適化を図っていく必要があります。
大手製薬企業などでは、例えば最適化段階で、200-300化合物を創出するのに5人程度の研究者が約1年間程度を費やしているものと思います。それらの評価を並行して実施し、検証を繰り返しながら最適化を進めるのが一般的です。リード探索段階においても同様な工程を経る必要があり、パラレル合成などを利用しても週に1000化合物を合成することは困難です。当社では、時間もコストも膨らむ多検体の合成を自動合成により低コスト・短期間で実現しています。もし合成した化合物に活性がなかったとしても2~3カ月で結果がわかるので、早期に中止して別のプロジェクトにフォーカスできるメリットがあります。
そのRaPPIDSを活用した現在のパイプラインについてお教えください。
蒲 自社パイプラインとしては、非小細胞肺がんやすい臓がんにおける癌免疫抑制の原因となるIRAK-Mというタンパク質、急性骨髄性白血病を対象疾患とするTRIB1というタンパク質など複数のパイプラインの研究を実施しています。
これら2つの標的タンパク質はいずれもシュードキナーゼというクラスに属し、undruggableとされてきたタンパク質です。シュードキナーゼは偽キナーゼとも呼ばれ、キナーゼ活性を持たないので従来の創薬技術では薬を作れないとされてきました。ところが、これに標的タンパク質分解誘導剤の技術を組み合わせることにより、薬にすることができる相性のいい標的クラスです。私たちはシュードキナーゼだけにフォーカスしているわけではありませんが、1つのアプローチとして標的タンパク質分解誘導剤と相性がいいと評価されてきた標的クラスであり、それらを狙って自社開発を進めています。
一方、RaPPIDSを活用して製薬企業との共同研究による共同開発パイプラインを構築しています。その1つが2022年2月1日に発表したアステラス製薬株式会社との複数の標的に対する標的タンパク質分解誘導剤の共同研究です。当社独自のE3リガーゼバインダー(組織選択的、がん選択的な発現を有するE3リガーゼを含む)と効率的な標的タンパク質分解誘導剤合成技術に期待していただき共同研究を開始することができました。共同研究プログラムは当社のプラットフォームから価値あるアセットを継続的に生み出せることを示すためにも重要なビジネスモデルと考えています。
RaPPIDSの改良・開発を加速し技術的価値を高める
今後、自社創薬と共同研究を推進していくうえでの今後の構想をお聞かせください。
冨成 米国などのベンチャーは資金力が大きく、先行するベンチャーだけでなく後発のベンチャーでさえ、すでに株式公開で資金調達している会社もあります。これらと競合していくためには、プラットフォームを活用した共同研究事業で大きなディールを獲得する必要があります。それには私たちのプラットフォームの価値をいかに高めるかが重要であり、技術的にもさらに洗練させていかなければなりません。
一方、日本およびアジアにおける標的タンパク質分解誘導剤の研究開発の活性化にも貢献していきたいと思っています。その一端として、標的タンパク質分解誘導剤の研究領域で世界的に著名な研究者が一堂に会して情報交換の機会を提供する「2nd Targeted Protein Degradation Conference in Japan」を2023年7月26~27日に湘南ヘルスイノベーションパークで開催する予定です。2019年に続く第2回目の開催で、22人の講演者のうち半数が海外のエグゼクティブクラスであり、最先端の研究成果が参加者に共有され、日本の標的タンパク質分解誘導剤の研究がさらに活性化されるものと期待しています。
最後に、起業を考えている人にアドバイスをお願いします。
冨成 創薬研究に携わっている人たちが対象になりますが、自身で興味深いアセットがあるなら起業してみるべきだと勧めます。現在所属する会社の了承が前提になりますが、チャンスがあったら立ち上がらないと二度と機会はないと思います。スピンオフの機会があるならば起業後の失敗を考えるのではなく、何をやったら成功するかのイメージで突き進むべきだと思います。
蒲 私は感覚的に決断するタイプですが、最終的に信じられるのは自分自身だというポリシーを持っています。起業にリスクが伴うのは当然ですが、信じられるのは自分ですし、失敗しても自分の責任と割り切って挑戦しました。ただ、一人ではなし得ないので考えに共感してくれる仲間がいるかどうかは大きいと思っています。
この記事は、京都iCAPのウェブサイトに掲載されたものです



